Científicos del New Jersey Institute of
Technology (EE.UU.) han desarrollado un hidrogel peptídico para
pacientes con lesión craneocerebral, que contribuye a la aparición de
nuevos vasos sanguíneos y a la supervivencia de las neuronas.
Experimentos con ratas han demostrado la eficacia del hidrogel, informa
el portal EurekAlert! Los investigadores presentarán los resultados en
la Reunión Nacional de la Sociedad Química Americana (ACS) este otoño.
La
lesión craneocerebral (CMT) es el tipo más común de lesión, que a
menudo conduce a la discapacidad. Caerse de una altura, golpear la
cabeza con fuerza y un accidente de tráfico son las principales causas
de la CMT. Hay dos tipos de lesiones en el traumatismo craneal. El daño
primario ocurre en el momento de la lesión. Una lesión secundaria puede
ocurrir unos segundos después del CHMT y durar muchos años. Desencadena
el estrés oxidativo, causa inflamación y alteración de la barrera
hemato-encefálica, una barrera que protege el sistema nervioso central
de las sustancias extrañas que entran en el torrente sanguíneo. «El
trauma secundario crea un ambiente neurotóxico que puede conducir a
efectos cognitivos a largo plazo», dice Biplab Sarkar, uno de los
autores del desarrollo. Por ejemplo, los sobrevivientes de CHF pueden
experimentar deterioro de las habilidades motoras y aumento de la
depresión, agrega el investigador.
Biplab
Sarkar y Vivek Kumar, el director del proyecto, querían desarrollar una
terapia que pudiera ayudar a tratar lesiones secundarias.
Anteriormente, habían desarrollado péptidos que podían ser recolectados
en hidrogeles mediante inyección bajo la piel de los roedores. Al
incluir fragmentos de secuencias de proteínas específicas en los
péptidos, el equipo puede darles varias funciones. Por ejemplo, Sarkar y
Kumar han desarrollado previamente hidrogeles de péptidos angiogénicos
que desarrollan nuevos vasos sanguíneos cuando se inyectan bajo la piel
de ratones.
Al adaptar su tecnología al cerebro, los
científicos han cambiado las secuencias peptídicas para acercar las
propiedades materiales del hidrogel a las del tejido cerebral, que es
más blando que la mayoría de los demás tejidos del cuerpo. También han
añadido una secuencia de ependimina, una proteína neuroprotectora. Un
nuevo hidrogel peptídico fue probado en un experimento en ratas con
CHMT. Cuando se inyectan en el sitio de la lesión peptídica, los
péptidos mismos comienzan a acumularse en un hidrogel, que actúa como un
«nicho» protector al que se pueden adherir las neuronas.
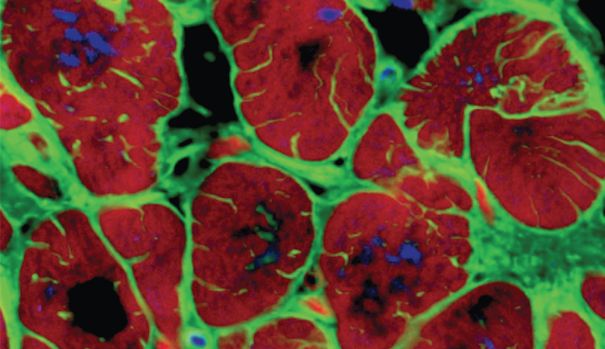
Una
semana después de la introducción del hidrogel, el equipo revisó el
cerebro de las ratas. Los científicos han descubierto que con el
hidrogel, la tasa de supervivencia de las células cerebrales ha mejorado
significativamente: el número de neuronas en el sitio del daño se ha
duplicado. Además, los investigadores han visto señales de la formación
de nuevos vasos sanguíneos.